
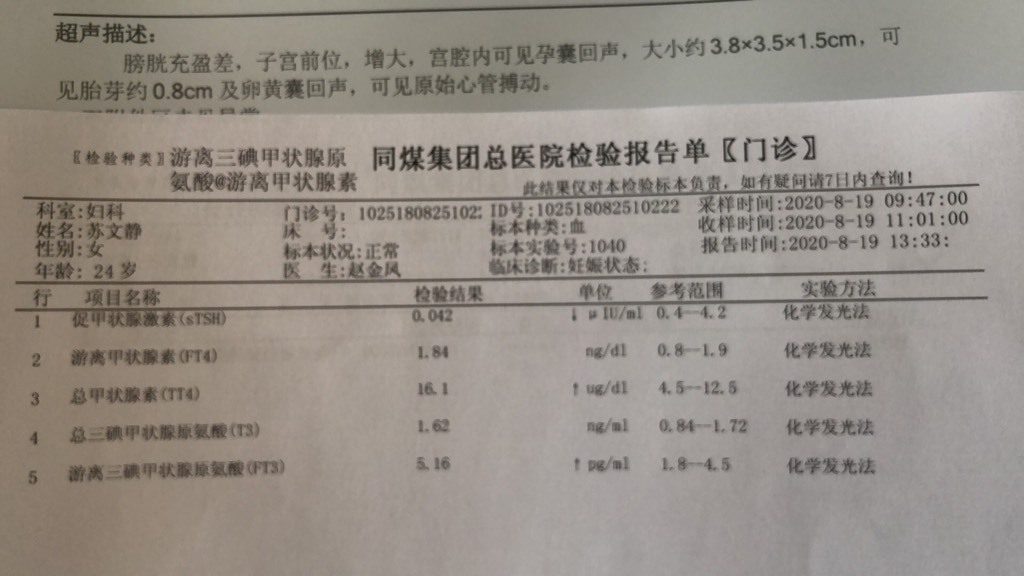
甲状腺乳头状癌(PTC)是甲状腺癌最常见的构造学亚型,其发病率在环球范围内连续数十年增长。大多数PTC患者预后较好,然而仍有15-20%的患者会出现疾病复发乃至是殒命。因此,怎样能有效筛选出这部分高危患者并可以或许针对性的治疗(如精密监测或加强干预步伐)黑白常紧张的。2015年《美国甲状腺协会管理指南》将BRAF突变与原发灶巨细、腺外陵犯等细化肿瘤特性整合纳入中危风险分层,若肿瘤大于1cm同时伴TERT突变±BRAF突变者纳入高危风险分层,用以评估预后及治疗决定。2016年我国发布了《甲状腺微小乳头状癌诊断与治疗中国专家共识》提到符合下列一条高伤害因素的PTMC患者均发起行手术治疗,此中一条高危因素为穿刺标本检测BRAF基因突变阳性。
图1、2015年美国甲状腺协会(ATA)《成人甲状腺结节和分化型甲状腺癌的管理指南》
图2、《甲状腺微小乳头状癌诊断与治疗中国专家共识(2016版)》
以往以为BRAFV600E是猜测PTC不良预后的紧张辅助本领,而随着研究的不绝增多,关于仅凭BRAF单一突变是否可以代表一个可靠的预后标记物备受争议,从比年发布的指南和共识来看,单纯依靠BRAF突变引导患者预后的临床职位已下滑。2019年发布的关于甲状腺微小乳头状癌巴西专家意见书中指出,RAS突变或其他RAS样突变或BRAFV600E或其他BRAFV600E样突变不应影响临床管理。然而,一些少见的低风险甲状腺微小乳头状癌(mPTC)患者携带高风险突变,如TERT启动子突变或p53突变,则不得当主动监测。2020年美国内分泌外科协会(AAES)发布的指南提到BRAFV600E已被广泛研究与更具侵袭性的PTC亚型相干,BRAFV600E突变肿瘤也与复发有关,纵然在PTMC中也是云云。当PTC为单发且巨细为1-4cm时,BRAFV600E突变患者复发的大概性更大(9.5%vs3.4%)。然而,并非全部BRAFV600E突变PTC都与侵袭性疾病有关。总体而言,当构造学特性可用于细化风险分层时,BRAFV600E的预后代价的有限。别的提到BRAFK601E突变肿瘤在临床上表现为惰性,不应与BRAFV600E肴杂。
图3、2019年发布的关于甲状腺微小乳头状癌巴西专家意见书
图4、《2020AAES指南:成人甲状腺疾病的明白手术治疗》
2020年的发布的《甲状腺癌基因检测与临床应用广东专家共识(2020版)》提到BRAF和TERT启动子双突变在PTC发生率为7.7%,双突变协同效应猜测甲状腺癌的恶性程度高,与单基因BRAF或TERT突变相比,颠末15年随访,双基因突变肿瘤复发率显着升高、预后不良、殒命率高。专家组意见为腺叶切除及患侧中心区淋巴结排除是DTC的根本治疗术式。是否必要扩大手术范围,可连合基因变异(如BRAF/RAS归并TERT、PIK3CA、TP53等)判定肿瘤复发伤害度。在2022年卫健委发布《甲状腺癌诊疗指南(2022年版)》将BRAFV600E突变阳性的甲状腺腺内乳头状癌(直径1~4cm)、BRAFV600E突变阳性的多灶的甲状腺微小癌归并腺外浸润归为中风险分层,在高风险分层中并未提及。
图5、《甲状腺癌基因检测与临床应用广东专家共识(2020版)》
图6、2022年卫健委发布《甲状腺癌诊疗指南(2022年版)》
为什么随着比年研究的不绝深入,单基因BRAFV600E检测辨认高危PTC患者的临床意义越发有限呢?尤其对于亚洲的PTC患者。除了差别研究之间患者的选择、构造学范例、检测的方法(差别方法学灵敏度差别)等差别,尚有一个重要缘故起因是2017年从前很多BRAF的预后猜测数据是西方PTC患者队列研究得出来的,西方PTC的BRAFV600E突变频率较低(35-50%),来自亚洲的大多数数据却报道了相称高的BRAFV600E突变频率(50-90%),而预后不良的患者仅占15-20%,表明很多低风险PTC也携带该突变,因此简单从数据上来看就发现亚洲DTC患者云云高频的BRAF突变率失去了临床筛选高危患者的引导意义。因此大量的临床研究结果夸大了BRAF突变连合其他多基因检测结果综合评估引导复发风险的意义。
BRAF+TERT突变
TERT启动子(TERTp)的两个突变(C228T和C250T)在PTC中的突变率约为10%。2020年发表的这项聚集分析[1]评估BRAFV600E和TERTp突变对PTC患者的预后代价。研究者共分析纳入4184名PTC患者的12项研究,统共有2412(57.6%)的患者携带BRAFV600E或TERTp突变,290(6.9%)名患者同时携带两种突变。TERTp突变在BRAFV600E突变患者中更为常见(RR=1.75[1.93-4.35])。与携带单一突变的患者相比,携带两种突变的患者预后更差(与仅BRAFV600E相比:RR=5.34[4.20-6.78]与仅TERTp相比:RR=2.12[1.41-3.19])。BRAFV600E突变的PTC患者更有大概携带TERTp突变。TERTp突变是PTC患者预后不良的独立猜测因素(RR=2.90[1.93-4.35]),然而与TERTp突变相比,BRAFV600E突变的预后作用相对有限(图7)。由于亚洲人群的某些特定特性,仅发现BRAFV600E突变对肿瘤复发的猜测代价在亚洲以外人群中具有统计学意义。因此应该全面评估分子检测结果,而不是关注单个突变。基于分子的PTC风险分层总结为BRAF+TERT+BRAF-TERT+BRAF+TERT-。
图7
2015年ATA指南扩大了甲状腺腺叶切除术(LT)的顺应症,基于证据表明LT可为T1或T2N0M0分期患者提供精良的长期预后,而且与LT相比,甲状腺全切除术(TT)与诸如甲状旁腺功能减退、喉返神经麻痹等并发症的风险明显增长有关。别的,全部担当TT的患者都必要终生甲状腺激素更换治疗。自该指南发布后,低风险患者中担当甲状腺腺叶切除术的比例明显增长。然而,纵然低风险患者也会出现肿瘤复发和疾病特异性殒命,因此必要筛选符合的生物标记物猜测PTC的预后并确定初始治疗方式。2020年日本医科大学附属医院报道了一项研究[2],纳入连续685例担当原发性甲状腺手术的PTC患者,初次手术后的均匀随访时间为10±3年。基因检测结果表现538名(78.5%)携带BRAFV600E突变,133名(19.4%)携带TERT启动子突变。大多数(126/133)携带TERT启动子突变的患者同时携带BRAF突变,只有7名患者仅携带TERT突变。因此,与该人群中的TERT突变相比,BRAFV600E突变并不是与疾病特异性生存率(CSS)和无病生存率(DFS)相干的更好指标。研究者仅分析TERT启动子突变来评估甲状腺切除范围与1-4cm甲状腺内PTC患者预后之间的关系。具有TERT突变的患者比没有突变的患者表现出显着更差的临床了局(10年CSS:73.7%vs98.1%,p0.001;10年DFS:53.7%vs93.3%,p0.001)。担当腺LT的患者与担当TT的患者相比,10年CSS和10年DFS无明显差别,而TERT未突变的PTC患者(直径1-4cm)可从LT得到精良的预后。克制对这部分患者举行TT表明大概防止太过治疗和镌汰术后并发症。
图8、携带或不携带TERT启动子突变的患者的疾病特异性和无病生存曲线
BRAF+其他突变
2021年《临床癌症研究》上发表了一项研究[3]回顾了225名BRAFV600E突变型PTC患者的临床病理数据,并将其与来自肿瘤样本的NGS数据相连合分析。结果在16%的肿瘤样本中发现了额外的致癌基因变异。BRAF+“其他突变”组的患者更有大概处于美国甲状腺协会(ATA)分别的高复发风险组中(48.6%vs17.6%;P=0.0009),其有更大的基线肿瘤负荷(2.7vs1.9厘米;P=0.0005)和更高的疾病分期阶段(14.3%vs1.1%4期;P0.0001)。紧张的是,在65个月的随访中,仅BRAF突变组与BRAF+其他突变组相比更有大概履历疾病特异性盼望,而且疾病特异性殒命(DSM)的风险增长(BRAF+其他突变组为13.8%,而仅BRAF突变组为1.4%;P=0.005)。别的还确定了在PI3K/AKT/mTOR通路中存在关键致癌突变的患者亚群,这些突变患者与DSM独立相干(OR=47.9;P=0.0043),与疾病分期无关。该研究表明辨认BRAFV600E突变PTC患者携带的其他PIK3/AKT/mTOR通路相干变异可猜测更具侵袭性的临床病理特性,并大概确定获益靶向治疗的候选者。这些数据支持对PTC患者举行更广泛的基因分析,可得到紧张且可干预的预后风险分层意义,以引导临床治疗战略。
图9、BRAF+“其他突变”队列(n=35)中致癌基因变异的分布
BRAF突变等位基因频率(MAF)
2022年中国医学科学院北京协和医院发表了一项多中心研究,回顾性分析了2018年5月至2020年12月期间从国内14家医院网络的先前未经治疗的395名PTC患者的数据。高危病理特性界说为T3/T4、N(+)和N1b(+)。通过NGS分析表现有78.5%的患者(n=310/395)存在BRAF突变,且均为BRAFV600E突变。与来自TCGA数据举行比力发现本研究中BRAF突变的发生率明显高于美国PTC人群(59.7%,p0.001),而RAS(n=8)、TERT(n=9)和PIKC3A(n=2)不常见。低风险组(MAF2.54%)和中风险组(MAF为2.54%-16.93%)相比,BRAF突变等位基因频率(MAF)16.93%与明显更高的淋巴结转移(LNM)、侧淋巴结转移(LLNM)和T3+T4期风险相干。与RET阴性患者相比,携带RET融合的患者具有更高的T、N和N1b分期。与没有多个驱动突变的患者相比,有多个驱动基因突变的患者观察到与T、N和N1b分期雷同的结论。然而,无论基因特性怎样,45岁以下的患者LNM和LLNM的发生率更高。总的来说,该研究中表明BRAFMAF大于16.93%,携带RET融归并具有多个驱动基因突变的PTC更具有侵袭性。这些特性大概被以为是PTC高风险人群的基因特性,在此类人群中大概必要更积极的治疗战略。
图10、395例中国甲状腺乳头状癌(PTC)患者的临床及基因变异特性
单一BRAFV600E突变的预后和猜测本领存在一些不确定性,由于大部分预后精良的PTC中(包罗没有淋巴结转移的微小乳头状癌)也可检测出BRAF突变,应与其他基因变异一起评估。如今甲状腺基因检测的项目包罗了越多越多的紧张基因,如TERT、RAS、PIK3CA、TP53、RET等,多项研究结果表明BRAFV600E与这些基因突变的组合检测成为美满DTC患者预后分类的有力工具。很大概在不久的将来,TNM分类体系会将临床病理和分子特性综合评估,有效改善这类患者的预后。
参考文献:
[1]ThepredictivevalueofcoexistingBRAFV600EandTERTpromotermutationsonpooroutcomesandhightumouraggressivenessinpapillarythyroidcarcinoma:Asystematicreviewandmeta-analysis.ClinEndocrinol(Oxf)202105;94(5)
[2]TERTPromoterMutationandExtentofThyroidectomyinPatientswith1-4cmIntrathyroidalPapillaryCarcinoma.Cancers(Basel)2020Jul30;12(8)
[3]OncogenicMutationsinPI3K/AKT/mTORPathwayEffectorsAssociatewithWorsePrognosisin-DrivenPapillaryThyroidCancerPatients.ClinCancerRes20210801;27(15)
[4]BRAFGeneticandClinicopathologicCharacteristicsofPapillaryThyroidCarcinomaintheChinesePopulation:HighMutationAlleleFrequency,MultipleDriverGeneMutations,andFusionMayIndicateMoreAdvancedTNStage.OncoTargetsTher2022;15
我要评论